Determinação do potencial Eh de oxi-redução
A determinação é feita usando um potenciômetro do mesmo tipo usado para medir o pH, sendo o sensor um eletrodo de platina. Na determinação do pH o sensor não é um eletrodo de platina e sim o “eletrodo de vidro”.
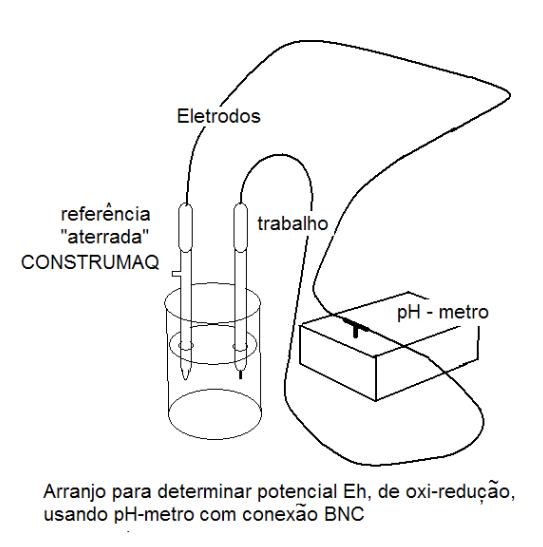
Nos dois casos se mede uma diferença de potencial entre um eletrodo de referência e o eletrodo de trabalho. O eletrodo de referência se liga ao “terra” do potenciômetro e o sensor ao polo ”vivo”.
Potenciômetros antigos tinham entradas para conectores tipo banana, tanto para o eletrodo de referencia como para o de trabalho. Em potenciômetros modernos de pH duas modificações foram incorporadas: o conector passou a ser bipolar, do tipo BNC, e os dois eletrodos, o de trabalho e o de referência passaram a ser construídos dentro de uma só haste, o conjunto sendo denominado “eletrodo combinado de pH”. Neste novo sistema continua o eletrodo de referencia ligado ao “terra” que no caso do conector BNC é o pólo externo.
Um eletrodo de platina, sensor do potencial Eh com conector BNC fica eletricamente ligado ao eletrodo central do conector mas o eletrodo externo do conector permanece não conectado. Ligando este eletrodo a um pH-metro com conector BNC fica faltando uma ligação do pólo “terra”a um eletrodo de referencia para que se possa fazer medidas de Eh.
Para suprir esta falta se pode construir um eletrodo de referência especial, com um conector BNC, no qual o eletrodo de referencia fica eletricamente ligado ao pólo externo do conector e o pólo central do conector fica não conectado. Por ser ligado ao pólo terra ele pode ser chamado de “aterrado”.
O conector “T” do padrão BNC, com duas entradas e uma saída, é disponível no comércio. Com ele pode ser feito um arranjo: o eletrodo de platina pode ser ligado a uma das entradas do T e o eletrodo especial de referência à outra. Assim, a saída do T terá o seu pólo vivo ligado ao eletrodo de platina e seu “terra” ao eletrodo de referência, condição correta para o T ser ligado na entrada BNC para fazer medidas de Eh com o pH-metro.
A figura mostra ambos eletrodos mergulhados em becher contendo um liquido. Mas para medir o potencial Eh eles podem estar fincados em um solo, em amostra de sedimento de um lago, em uma cultura de fermentação etc.
Resta interpretar corretamente, em termos de potencial redox, a leitura mostrada no potenciômetro de pH. É uma tarefa simples pois a escala do potencial Eh, expressa em milivolts [mV], e a escala do pH diferem por um fator multiplicativo, isto se antes de se fazer a medida do Eh o pH-metro estava calibrado corretamente para medir o pH com seu eletrodo combinado.
A tarefa fica mais simples ainda se o pH-metro tem opção de ambas escalas, milivolts ou pH, mediante seleção por um interruptor. Em tal caso se escolhe a escala milivolts e se mede o potencial Eh diretamente em mV.
Mas quando o pH-metro tem como única opção a escala do pH, se lê o valor mostrado nela, para em seguida
convertê-lo a milivolts por cálculo. Seja, este valor lido, simbolizado por {pH}. O valor do Eh correspondente, em [mV], será:
Eh = 59 x {pH} (eq 1)
A constante C1 = 59 mV está correta quando a temperatura T1 do substrato é de T1 = 300 [K]. Para outra temperatura T2 , a constante C2 precisa ser ajustada de acordo com a proporção seguinte:
C2 / 59 = T2 / 300
Um exemplo:
Um pH-metro corretamente calibrado para medir o pH precisa ser usado para medir potencial Eh de oxi-redução de uma solução aquosa de sulfito de sódio que está a uma temperatura de 27o C (=300K). Após remover o eletrodo combinado se ligou o pH-metro a um T conectado para medir Eh como na figura acima. O valor lido foi 4,46. Qual é o valor do Eh?
Solução:
Eh = 59 x 4,46
= 263 mV
Outro exemplo:
Medidas de Eh feitas em 4 soluções com arranjo similar ao da figura acima, em T=298K:
| solução | {pH} | Eh |
| NaClO * ~ 0,6 M | – 3,10 | – 182 mV |
| Na2SO2 1 M | 6,22 | 365 mV |
| NaH2PO2 1 M | – 0,27 | – 16 mV |
| água da torneira | – 1,28 | – 75 mV |
* Solução de hipoclorito de sódio (“água sanitária”) com ~2% de “cloro ativo”
as soluções de sulfito e de hipofosfito foram feitas com água da torneira
O texto acima se baseia na equação de Nernst que é:
Eh = Eo, + ( R T / F) ln[H+]
onde Eo,= 0 devido à calibração do pH-metro; R = 8,314 joule K-1 mol-1; F = 96500 coulomb por equivalente; e [H+] a concentração de íons de hidrogênio, em equivalentes por litro, por exemplo na ocasião de calibração do pH-metro.